刘静,刘燕,郑笑为,汪祺,聂黎行,何轶,胡晓茹,何风艳,王亚丹,鲁静,戴忠通信作者,马双成通信作者
中国食品药品检定研究院,北京 100050
中成药作为我国特有的中药制剂,品种众多、剂型多样、临床应用范围广泛。随着中药现代化进程的不断推进,中成药产业发展迅速,作为临床直接使用的药品,其质量直接关系到人民用药安全与疗效,因此,对其进行质量控制与评价意义重大。
国家药品抽检是对上市后药品监管的一个重要手段,采用分散抽样、集中检验、探索研究、综合评价的工作模式。自2008年实施以来,国家药品抽检一直对我国药品质量控制、质量评价及监管等起到重要作用。2008—2021年,中国食品药品检定研究院中药民族药检定所中成药室(以下简称中成药室)负责完成了18个中成药品种、共计2149批次样品的国家药品抽检工作。对各品种质量分析报告进行总结与分析,结果表明各品种标准检验合格率高,但探索性研究也发现一些与安全性、有效性和均一性相关的质量问题;与此同时,还对工作成果、创新质量评价模式等关注点进行概括;在此基础上,提出了一些关于中成药国家药品抽检工作的思考与建议,以期为中成药质量的进一步提高提供参考,从而更好地保障人民用药的安全性与有效性。
1、基本情况
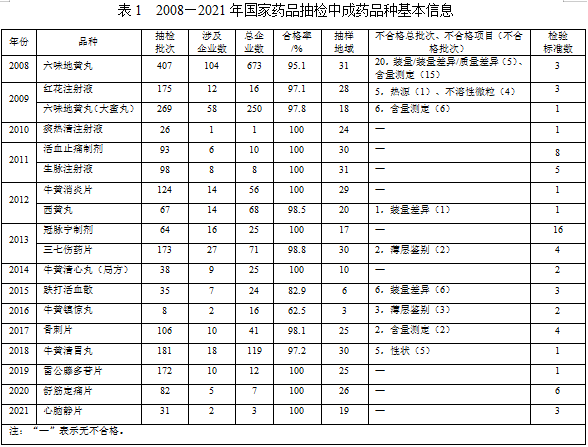
2008—2021年,中成药室共负责完成六味地黄丸、红花注射液等18个中成药国家药品抽检工作(表1),剂型涉及丸剂、注射剂、散剂、片剂和胶囊剂。其中,六味地黄丸、活血止痛散和西黄丸收载于《国家基本药物目录(2018年版》)。
国家药品抽检样品采取全国地域范围内广泛抽样的模式,以充分保证样品的代表性。18个品种共计抽检2149批次,除牛黄镇惊丸抽样8批外,其余品种抽样批次在几十至几百批,以六味地黄丸抽样批次最多,高达407批。抽样地域分布方面,除牛黄镇惊丸、牛黄清心丸(局方)和跌打活血散抽样不多于10个省、市、自治区、直辖市外,其余15个品种地域覆盖范围均较广泛。各品种抽检基本涉及生产企业、经营单位及医疗使用单位等不同环节,并均以经营单位抽样为主。
2、标准检验结果
2008—2021年,18个中成药品种检验标准涉及《中华人民共和国药典》(以下简称《中国药典》)2005年版、2010年版、2015年版和2020年版、《中华人民共和国卫生部药品标准·中药成方制剂》及国家药品监督管理局标准等,共计65项检验标准。冠脉宁制剂(片剂和胶囊剂)涉及检验标准最多,高达16项。标准检验合格率方面,痰热清注射液、活血止痛制剂等9个品种合格率均为100%;六味地黄丸、红花注射液等7个品种合格率均高于95%;2个品种合格率低于90%,牛黄镇惊丸合格率最低,仅62.5%,不合格项目均为薄层鉴别项,涉及3批样品。18个品种不合格项涉及性状、装量、装量差异、质量差异、热源、不溶性微粒、薄层鉴别和含量测定等检验项目(表1)
3、标探索性研究结果分析
2008—2021年,除红花注射液和雷公藤多苷片处方为单味药外,其余16个品种均为复方制剂,处方药味涉及3~29味中药,以牛黄清心丸(局方)处方药味最多,高达29种。因此,为更全面地考察药品质量,结合各品种处方特点及市场上相关原料药的潜在质量问题,深入开展了与药品安全性、真实性、有效性和质量均一性相关的一系列研究工作。
3.1 安全性相关
随着公众安全用药意识的不断提高,中药安全性问题备受关注。18个中成药品种安全性研究内容主要涉及重金属及有害元素、黄曲霉毒素、农药残留、染色等外源性有害残留及处方饮片本身所含内源性毒性成分。整体研究结果表明,外源性安全性风险以重金属及有害元素相对较高,内源性安全性方面处方饮片除朱砂、雄黄外,其他药材所含内源性毒性成分安全性风险很低。
3.1.1 重金属及有害元素 活血止痛散、牛黄清心丸(局方)和心脑静片等12个品种分别采用电感耦合等离子体-质谱法(ICP-MS)、ICP-原子发射光谱法(ICP-AES)、原子荧光光度法(AFS)、原子吸收分光光度法(AAS)对铅、镉、砷、汞、铜5种重金属及有害元素进行分析。此外,处方中含有朱砂和/或雄黄矿物药的牛黄清心丸(局方)等3个品种还进一步结合高效液相色谱-ICP-MS(HPLC-ICP-MS)等对可溶性砷、汞的含量及其价态进行了深入分析。参照《中国药典》2020年版部分药材中5种重金属及有害元素的限量规定:铅不得过5 mg·kg–1,镉不得过0.3 mg·kg–1,砷不得过2 mg·kg–1,汞不得过0.2 mg·kg–1,铜不得过20 mg·kg–1,检测结果整体不容乐观,各品种均存在个别元素不同比例、不同程度的超标问题,尤以个别批次样品中铅、砷和汞超标严重。处方含朱砂和/或雄黄品种中汞和砷的价态研究显示,可溶性汞中以Hg2+为主,可溶性砷以As3+和As5+为主,但仍存在未知价态形式。鉴于重金属及有害元素对人体的危害性,特别是对于朱砂、雄黄等矿物药的质量控制仍须持续关注与重视。
3.1.2 黄曲霉毒素 活血止痛散、西黄丸和牛黄清胃丸(局方)等7个品种针对黄曲霉毒素进行检测分析,结果活血止痛散和舒筋定痛片2个品种发现黄曲霉毒素超标的问题,以活血止痛散问题较为严重,两者处方均含有易霉变的土鳖虫。研究结果提示,对存在易霉变问题的土鳖虫等原料药材的质量及存储方式等加强风险防控与监管。
3.1.3 农药残留 牛黄清心丸(局方)、跌打活血散、牛黄镇惊丸、骨刺片和牛黄清胃丸5个品种分别针对20余种有机氯、有机磷或拟除虫菊酯类农药残留进行检测分析,结果除跌打活血散个别批次六氯苯超限外,其余所有抽样均合格,初步表明中成药整体农药残留水平较低。
3.1.4 染色 红花注射液、牛黄消炎片和冠脉宁制剂等11个品种分别针对处方中可能存在染色问题的红花、青黛、血竭等原料药开展了金橙Ⅱ、柠檬黄、苋菜红、胭脂红、日落黄、苏丹红Ⅰ、苏丹红Ⅳ、金胺O、808猩红、亮蓝、孔雀石绿等共计20余种染料的筛查,方法主要涉及薄层色谱法(TLC)、HPLC和/或液质联用法(HPLC-MSn)。研究结果显示,牛黄消炎片、冠脉宁制剂、三七伤药片和牛黄清心丸(局方)4个品种个别批次分别检出孔雀石绿,苏丹红Ⅰ、苏丹红Ⅳ和808猩红,胭脂红和柠檬黄,金胺O和808猩红。随着连续多年有关检查染色问题补充检验方法的实施,中成药的染色问题明显好转,最终会得到有效遏制。
3.1.5 内源性毒性成分 三七伤药片、骨刺片和雷公藤多苷片3个品种处方中涉及毒性饮片,包括制草乌、雪上一枝蒿、附片、制川乌、马钱子粉和雷公藤。三七伤药片处方中制草乌和雪上一枝蒿含有乌头碱、新乌头碱和次乌头碱等双酯型乌头类生物碱,这类成分具有极强的中枢神经系统毒性,用药剂量与中毒剂量接近,通过采用HPLC测定其含量,结果表明所有样品中双酯型乌头类生物碱总量均低于拟定限度。骨刺片处方中含有附片、制川乌、制草乌和马钱子粉4种毒性饮片,一方面通过采用液质联用法(LC-MS/MS)测定双酯型乌头类生物碱含量,所有样品测定结果均符合拟定限度;另一方面,以士的宁和马钱子碱为指标成分采用HPLC考察马钱子粉药味,测定结果均低于拟定限度要求。雷公藤多苷片是雷公藤去皮根部提取物经柱色谱净化后得到的粉末制成的片剂,其显著特点为活性和毒性并存,安全窗口窄;现行标准以雷公藤甲素为其毒性指标成分,规定每片雷公藤多苷片中雷公藤甲素含量不得超过10 μg,结果所有样品均符合规定。
此外,对于内源性毒性成分安全性还开展了基于体外细胞毒性、斑马鱼模式动物的相关探索与研究。雷公藤多苷片以RAW267.4细胞和HepaRG细胞为模型,从细胞存活率、生化指标及细胞凋亡等方面评价了雷公藤多苷片的毒性,结合抗炎和免疫抑制活性细胞实验结果表明,各企业样品活性和毒性差异较大,但活性和毒性呈现正相关,活性强的样品毒性也强。反之,活性弱的样品毒性也较弱。同时雷公藤多苷片的安全窗口窄,起效剂量、最大无毒剂量和高毒剂量很接近,说明制剂在发挥作用的同时可能会带来不良反应。骨刺片等品种还采用斑马鱼胚胎进行了急性毒性实验研究,结果表明测试样品均主要表现为高质量浓度下的致死作用和低质量浓度下的发育滞后;分析还显示,样品急性毒性与其中士的宁含量呈正相关性,但由于制剂所含成分种类复杂多样,影响斑马鱼胚胎发育的具体成分还有待进一步深入研究。
上述研究结果表明,内源性毒性成分整体安全性风险相对较低,但由于这些成分的特殊性,应继续加强相关质量控制,制订合理限度;同时应进一步对其毒性成分进行深入的体内外毒性相关研究,以更好地保障用药安全性。
3.1.6 其他 鉴于红花注射液、生脉注射液和痰热清注射液3个中药注射剂品种特殊的给药形式,重点对其所含金属离子(钾、钠和钙)、渗透压、大分子、吐温-80、异常毒性、溶血与凝集、过敏反应等安全性相关因素进行考察。结果发现,红花注射液部分样品钾离子含量较高;生脉注射液部分样品吐温80超量使用,个别企业产品渗透压值偏高。
活血止痛散、冠脉宁制剂和牛黄清胃丸等7个品种处方中含有冰片,由于冰片在合成或储存过程中均可产生樟脑,樟脑具有一定毒性,《中国药典》2010年版、2015年版和2020年版中规定冰片中含樟脑不得超过0.50%。上述制剂均采用气相色谱法对樟脑进行检查,结果部分冠脉宁制剂样品、活血止痛制剂和牛黄清胃丸样品中存在樟脑超限的问题。
活血止痛散、牛黄消炎片和跌打活血散等7个品种采用光释光法开展了辐照残留考察,结果各品种均存在部分批次高剂量辐照的问题。
活血止痛制剂与雷公藤多苷片还分别对塑化剂和残留溶剂进行考察,活血止痛制剂个别批次样品囊壳中检出少量邻苯二甲酸二丁酯(DBP),但含量远低于限度。雷公藤多苷片个别批次检出乙醇、三氯甲烷超标的问题。
3.2 真实性相关
随着国家药品监督管理部门监管力度的不断加大,当前市场上直接采用伪品替代正品使用的情况已得到有效遏制,但受经济利益驱使或同属近缘种外观性状难以甄别导致掺伪掺杂的现象还时有发生。2008—2021年18个品种中涉及真实性考察的处方饮片主要有大黄、乳香、牛黄、骨碎补、三七、薄荷、铁丝威灵仙、关黄柏等。
牛黄消炎片和牛黄清胃丸等4个品种处方中含有大黄,鉴于市场上商品大黄中存在以伪品大黄掺伪的问题,研究利用其与正品大黄特征性成分的差异,以土大黄苷为指标,研究并建立了相应的土大黄苷检测方法,包括TLC、HPLC检查方法及LC-MS/MS 验证方法。结果牛黄消炎片和跌打活血散均有部分样品检出土大黄苷,牛黄清胃丸、舒筋定痛片样品均未检出土大黄苷。
乳香、没药和血竭等树脂类药材为进口药材,价格较贵。市场调查发现,乳香中常有用松香掺伪的现象,而松香主要含有松香酸,会对人体产生一定的不良反应。因此,以松香酸为松香掺伪问题的检查指标,采用TLC、HPLC检查,并采用LC-MS联用方法进行验证,国家食品药品监督管理局已批复了中国食品药品检定研究院提出的乳香补充检验方法和检验项目(批准件编号:2011005)。活血止痛散、西黄丸、冠脉宁制剂、舒筋定痛片均有部分样品中检出松香酸成分。
牛黄(天然牛黄)为牛科动物牛的胆结石,产量较低、药源稀缺,属名贵药材。为缓解天然牛黄紧缺的问题,保证临床用药,自20世纪60年代起,我国陆续研制出人工牛黄、培植牛黄和体外培育牛黄,作为天然牛黄的代用品。国家食品药品监督管理局在“关于牛黄及其代用品使用问题的通知”(国食药监注【2004】21号)中,对牛黄的使用进行了严格规定:“对于国家药品标准处方中含牛黄的临床急重症用药品和国家药品监督管理部门批准的含牛黄的新药,可以将处方中的牛黄以培植牛黄、体外培育牛黄替代牛黄等量投料使用,但不得以人工牛黄代替”。西黄丸、牛黄镇惊丸作为上述规定范围内的品种,处方中的牛黄可以采用天然牛黄或体外培育牛黄投料。西黄丸采用TLC、HPLC分析游离胆酸、结合胆酸和胆红素成分,结果除1家企业部分样品标识的体外培育牛黄中未检出胆酸外,其余样品中的牛黄均与产品包装中牛黄标识类别一致。牛黄镇惊丸采用HPLC,根据牛磺胆酸与胆酸峰面积的比例,以及是否检出猪去氧胆酸为判断依据对牛黄及代用品进行鉴别,结果所用牛黄均与产品包装中牛黄标识类别相同。此外,牛黄清胃丸处方含人工牛黄,经测定胆酸和猪去氧胆酸含量,结果仅个别批次低于拟定限度。
骨碎补为水龙骨科植物槲蕨Drynaria fortunei(Kunze)J. Sm.的干燥根茎,是风湿病、骨关节病等病症常用中药。但由于近似种多、性状相似、地方习用等原因,长期存在骨碎补掺伪使用的问题,而骨碎补与其混淆品的化学成分差异较大,掺伪使用将导致骨碎补药材及相关中成药质量不稳定,影响用药的安全性和有效性。三七伤药片利用橙皮、香橼等与骨碎补特征性成分的差异,以橙皮苷和新橙皮苷为指标,研究并建立了橙皮苷和新橙皮苷的检查方法,结果发现个别批样品中检出橙皮苷或新橙皮苷,表明相关批次产品的骨碎补药材存在掺伪问题。舒筋定痛片采用液质联用技术分析,结果个别批次样品中检出新橙皮苷成分。
三七是五加科植物三七Panax notoginseng( Brurk.) F. H. Chen的干燥根和根茎。由于三七茎叶资源丰富、价格便宜,曾在国家药品抽验工作中发现某些企业存在以三七茎叶替代或部分替代三七投料的问题。因此,对处方中含有三七的活血止痛散、跌打活血散和骨刺片开展了三七茎叶掺伪研究。跌打活血散采用TLC、HPLC和实时荧光定量PCR技术对三七进行分析,结果均表明,个别批次样品存在一定质量问题。活血止痛散和骨刺片样品中均未检出三七茎叶指标性成分人参皂苷Rb3。
薄荷为常用中药材,是唇形科植物薄荷 Mentha haplocalyx Briq.的干燥地上部分,具有疏散风热、清利头目等作用。其同属植物留兰香M. spicata Linn. 作为蔬菜和香料作物,在我国也有广泛种植,是薄荷的一个常见伪品。两者在化学成分上有一定的区别,香芹酮是留兰香中的专属性成分,可通过鉴别香芹酮判断薄荷中是否混有留兰香。牛黄镇惊丸和牛黄清胃丸采用GC-MS技术,结果部分牛黄镇惊丸样品检出香芹酮。牛黄清胃丸部分样品中检出微量香芹酮,峰面积低于拟定限度,整体表明制剂中使用的薄荷原料掺伪留兰香的问题较小。
《中国药典》2020年版(四部)“成方制剂中本版药典未收载的药材和饮片”中规定,铁丝威灵仙为百合科植物短梗菝葜Smilax scobinicaulis C. H. Wright、鞘柄菝葜S. stans Maxim. 或华东菝葜S. siobold Miq. 的干燥根及根茎。由于铁丝威灵仙药材产量较少等原因,考虑可能存在以产量更高的威灵仙进行掺伪使用的问题。铁丝威灵仙与威灵仙分属百合科和毛茛科植物,化学成分差异较大,掺伪使用将导致铁丝威灵仙药材及相关中成药质量不稳定,影响用药的安全性和有效性。因此,心脑静片研究建立了以威灵仙伪品齐墩果酸为指标性成分的HPLC,结果所有样品均未检出齐墩果酸。
黄柏、关黄柏分别为芸香科植物黄皮树Phellodendron chinense Schneid.和黄檗P. amurense Rupr.的干燥树皮。长期以来黄柏的价格高于关黄柏,且因其化学成分相似,市场上常有关黄柏冒充黄柏的情况。研究显示,黄柏和关黄柏中均含有巴马汀和小檗碱,但两者峰面积比值差别显著,黄柏中巴马汀与小檗碱峰面积比值为0~0.026,关黄柏中巴马汀与小檗碱峰面积比值为0.175~0.897。心脑静片采用HPLC测定上述2个成分峰面积的比值,为0.001 9~0.017 6,结果符合文献结论,未发现关黄柏掺伪问题。
牛黄镇静丸中含有全蝎和僵蚕(炒)2味中药,本研究针对动物源性DNA的COⅠ基因采用PCR技术建立专属性鉴别方法,结果所有样品均可检出全蝎和僵蚕。
此外,各品种辅料相关的真实性考察主要涉及蜂蜜,通常炼蜜作为相关品种赋形剂,处方占比高,但由于蜂蜜存在掺加蔗糖、转化糖(果糖和葡萄糖)或使用饴糖(主要成分为麦芽糖)的情况,鉴于此,六味地黄丸(大蜜丸)研究建立了蔗糖、葡萄糖、果糖和麦芽糖的含量测定方法,结果部分样品批次存在添加蔗糖或使用饴糖的问题。
综合真实性研究结果,以近似种或含相同成分的药材替代或掺伪处方药材投料的现象时有发生,如树脂类药材掺松香问题,薄荷掺或混有留兰香等问题。应加强这方面的监管力度,尽快研究建立补充检验方法。
3.3 有效性
中成药处方不同,成分复杂多样,以单一或某几个指标成分往往难以全面评价药品质量,特别是对于标准未涉及药味的质量评价。针对这一问题,有效性的考察旨在实现处方中多数药味的鉴别与分析,方法主要涉及薄层色谱鉴别与多指标成分含量测定(超/高效液相色谱-紫外/蒸发光散射检测法(U/HPLC-UV/ELSD)、GC和LC-MS/MS)。整体研究结果显示,薄层色谱法考察结果表明,相关药味主要成分斑点均能检出,但不同企业有的样品薄层斑点的颜色深浅、大小不同,反映出企业间产品质量存在一定差异,如活血止痛散中当归、乳香和冰片的薄层色谱鉴别,牛黄清心丸(局方)中冰片、人参、白芍和甘草的薄层鉴别,牛黄清胃丸中人工牛黄、大黄和冰片的薄层鉴别等。个别品种部分批次存在部分药味未检出的情况,如骨刺片中桂枝和威灵仙的薄层色谱鉴别。多指标成分含量测定结果显示,各品种检测指标不同,企业间样品测定值存在较大差异,个别批次存在个别指标成分含量异常偏低,甚至未检出的情况,如个别企业骨刺片产品中芍药苷、柚皮苷和延胡索乙素等指标性成分存在含量极低或未检出的情况,表明白芍、骨碎补和延胡索等饮片原料可能存在质量和/或投料等方面的问题。需要特别指出的是,对于有效性的研究还进行了一些有益尝试,如舒筋定痛片和心脑静片基于能被吸收的成分才是有效成分的理念,采用动物模型开展了体内吸收成分的研究,为有效性控制提供了数据支持。此外,雷公藤多苷片以脂多糖(LPS)诱导的RAW267.4细胞为模型,从一氧化氮(NO)和分化抗原簇86(CD86)的表达等方面评价产品抗炎和免疫抑制活性。这些方法都为今后中成药的质量评价进行了开拓性研究。以上研究表明,有效性问题主要表现在原料药材的投料质量和投料量问题上,这些都是影响中成药质量的关键因素。
3.4 均一性
中成药质量均一性的考察与评价主要采用指纹图谱技术U/HPLC-UV/ELSD和GC)。综合18个品种质量分析报告,除应用“中药色谱指纹图谱相似度评价系统”(2004版、2012版)计算相似度外,还结合对照药材和/或对照品比对及LC-MS技术对色谱峰进行药味归属和/或成分指认。各品种相似度研究结果表明,部分品种除个别企业批次外,整体相似度较高,提示不同企业间样品整体质量相对稳定,如痰热清注射液、牛黄镇惊丸、牛黄清胃丸和心脑静片等;多数品种不同企业间样品相似度存在一定差异,同一企业内产品间相似度高。可能是生产工艺不统一等因素所致,如冠脉宁制剂、牛黄清心丸(局方)和雷公藤多苷片等;个别品种存在个别企业内部产品批次间相似度差异较大,不同企业间产品相似度波动更大的情况,表明中成药质量除受饮片投料影响外,还应注意工艺问题,只有合理、稳定的工艺才能生产出质量稳定、均一的中成药。
4、中成药国家药品抽检工作亮点
4.1 标准完善与提高
一些中成药品种由于受历史客观因素等限制,标准存在不完善或不够统一的情况,通过上述18个品种国家药品评价抽检工作,大大促进了部分相关品种质量标准的统一与完善,各品种均拟定了相关标准修订草案,部分品种拟定相关检查项补充检验方法。目前,已获批补充检验方法5项,包括牛黄消炎片中土大黄苷检查项补充检验方法(批准件编号:2014001)、冠脉宁片中苏丹红Ⅰ和苏丹红Ⅳ检查项补充检验方法(批准件编号:2014002)、跌打活血散中金橙Ⅱ检查项补充检验方法(批准件编号:2014005)、牛黄消炎片中孔雀石绿检查项补充检验方法(批准件编号:2014006)、舒筋定痛片中松香酸检查项补充检验方法(BJY202201)。上述标准完善相关工作成果为问题样品的研判处理提供了强有力的技术支持,并为药品监督管理部门提供了坚实的执法依据。
4.2 中成药质量评价创新模式——中药对照制剂
综合历年国家药品抽检结果,标准检验合格率高,而探索性研究能发现诸多质量问题,提示现有质量控制在反映药品质量优劣方面存在较大局限性。近年来,借助国家药品评价抽检平台,本课题组也在不断尝试引入更加契合中成药特点、真实全面反映产品质量的创新评价模式。因此,以牛黄清胃丸为研究对象,首次引入中药对照制剂这一新的中药标准物质形式及等级标准的概念,以中药饮片和制剂的风险为导向,对产品安全性、真实性、有效性、均一性和稳定性等方面开展深入研究,实现产品全处方控制的同时,对市场流通药品进行全面的质量评价与比对,为中成药质量控制与评价模式的创新与发展做出了积极表率。
4.3 基于体内外活性/毒性的安全性与有效性研究
中药安全性与有效性的研究与质量控制一直备受关注,长期以来的唯成分论局限性日益凸显。鉴于此,近年来本课题组选择舒筋定痛片等品种,分别进行了基于体内吸收的有效成分的研究、基于斑马鱼模式动物的急性毒性研究及细胞活性与毒性的测试研究等有效性和安全性研究,为中成药的质量评价做了有益探索与尝试。
5、中成药国家药品抽检工作思考与建议
5.1 标准制修订
国家药品抽检工作是基于全国范围内的广泛抽样,样品代表性好。同时,探索性研究在针对标准检验过程中发现问题的基础上,进行了进一步有关安全性、有效性、均一性的深入研究,包括方法的建立与优化、方法学验证等,积累了庞大的基础数据,与标准制订、修订工作紧密相关。因此,建议进一步搭建国家药品抽检与标准提高之间的快速通道,以更好地将这些数据转化应用,促进标准提升。
5.2 专项治理
综合18个中成药品种的质量分析报告,可以归纳出一些共性问题,如重金属与有害元素、掺伪、染色等,这些问题主要来源于中药饮片。因此,建议以专项研究形式对重点问题/中药饮片进行延续性研究,有利于以点带面地解决相关问题。只有源头上保证药材、饮片质量,同时结合严格的生产过程控制,才能切实保证中成药质量的安全与有效。
5.3 监管措施
中成药质量直接关系到人民用药的安全性与有效性。近年来,受中药资源紧缺等各种因素影响,中药出现了一些掺伪使假、偷工减料等问题,既影响到中成药的质量,也给国家药品监督管理部门提出了挑战。从历年中成药国家药品抽检工作报告分析,一些非法染色、部分药材掺伪使假问题,随着国家监管力度的不断加大,已然取得良好的治理效果,但个别突出质量问题还较为明显,仍需重视。药品监督管理部门对于国家药品评价抽检工作中发现的问题样品都及时组织研判,一经查实,及时处理。今后对于可能出现的药品质量问题,除国家药品监督管理部门实行有效的监管之外,还要充分发挥生产者的主体责任,共同推进中成药质量的不断提高,以更好地保障人民用药安全与有效。
参考文献略
引用格式:刘静,刘燕,郑笑为,汪祺,聂黎行,何轶,胡晓茹,何风艳,王亚丹,鲁静,戴忠,马双成.基于2008—2021年国家药品抽检的18种中成药质量分析[J/OL].中国现代中药:1-13[2022-08-03].DOI:10.13313/j.issn.1673-4890.20220527001.
声 明:转载此文是出于传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。联系电话:028-64775583,邮箱:kefu@zyctd.com。
为加强药品质量监管,保障公众用药安全,根据《中华人民共和国药品管理法》及相关法律法规,我省药品监管部门和检验机构对药品生产、经营和使用单位实施了监督抽检。现将本期药品抽检信息通报........
中国基金报记者赵心怡南深斥资6.6亿元,云南白药拟6.6亿元收购聚药堂100%股权。8月15日晚间,云南白药公告称,全资子公司云南白药集团中药资源有限公司拟以6.6亿元现金收购聚药堂100%股权...
编辑说:近日,国家医保局公布了十起药品领域欺诈骗保和违法违规案例。这是国家医保局会同相关部门开展应用药品追溯码打击回流药专项行动以来,公布的第二批典型案例,涉及倒卖医保药品、串换药品等。